与陈薇团队合作,这款新冠疫苗获批军队内部使用(组图)
6月29日港股盘前,康希诺生物(06185.HK)发布公告:其与军事科学院军事医学研究院生物工程研究所联合开发的重组新型冠状病毒疫苗(腺病毒载体)(Ad5-nCoV), 已于6月25日获得中央军委后勤保障部卫生局(下称:军委后保部)颁发的军队特需药品批件,有效期1年。
公告中介绍,Ad5-nCoV的I期及II期临床试验已在中国开展,并于6月11日完成II期临床试验揭盲。临床试验数据证实其具有良好的安全性,及较高的体液免疫及细胞免疫应答水平。
康希诺生物表示,总体试验结果表明,Ad5-nCoV具有预防由SARS-CoV-2(严重呼吸综合征2型冠状病毒)引起的疾病的潜力。根据《中国人民解放军实施〈中华人民共和国药品管理法〉办法》有关规定,Ad5-nCoV现阶段仅限军队内部使用,未经军委后保部批准,不得扩大接种范围。
公告同时提醒投资者:康希诺生物无法保证能最终成功商业化Ad5-nCoV。
今天港股开盘,康希诺生物-B高开4.2%,盘中最高涨幅达8%,截至发稿,涨幅回落至1.91%,市值499亿港元。今年以来,其股价涨幅高达284%。
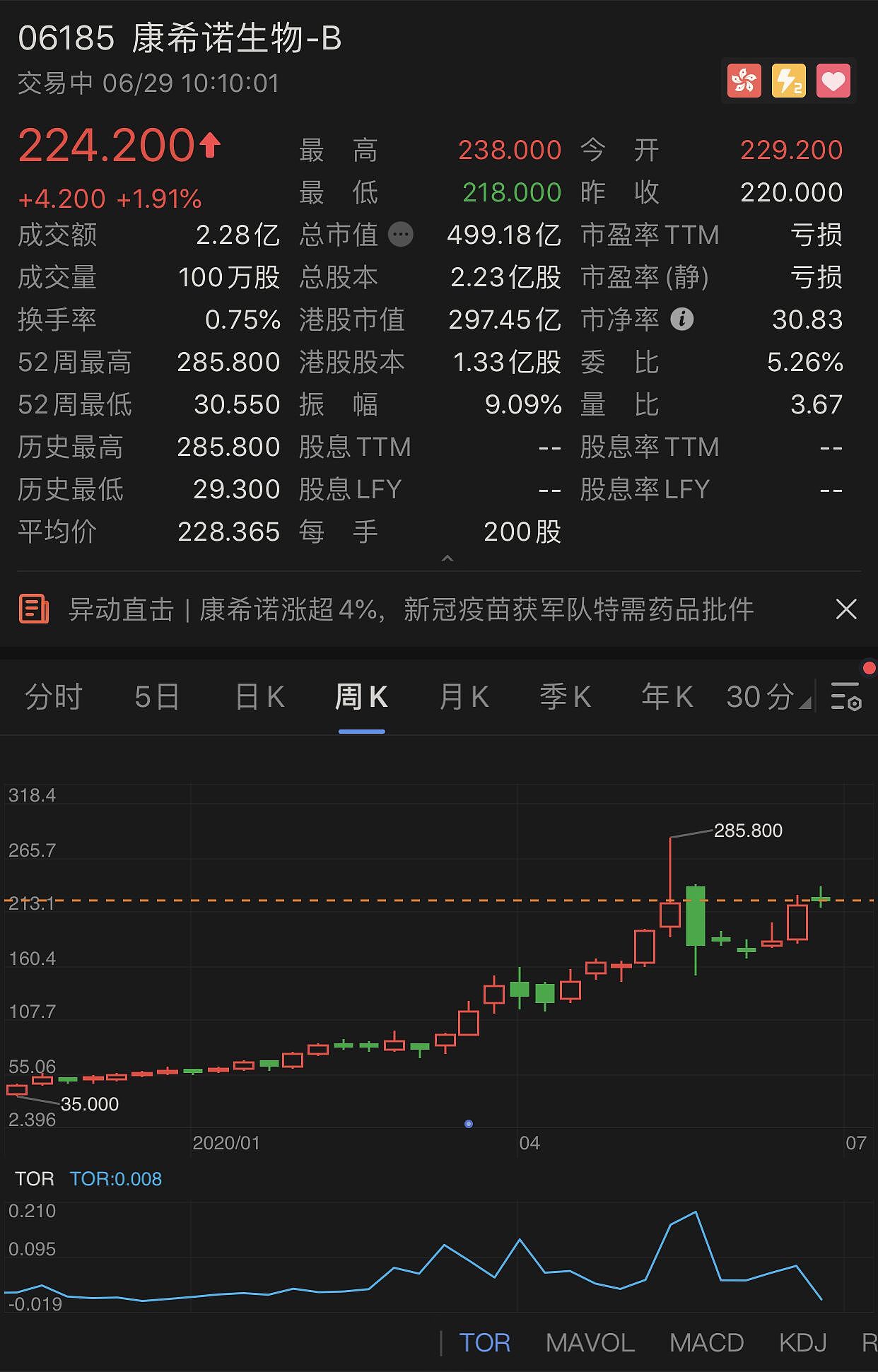
康希诺生物股价走势(周K)
2009年,康希诺生物注册于天津滨海新区,去年3月赴港上市,从事人用疫苗的研发、生产和商业化。今年1月,其正式递交科创板上市申请并获受理,拟募集资金用于新型疫苗产能扩大与产品研发。
此次获批的Ad5-nCoV疫苗由康希诺生物和军事科学院陈薇院士团队联合开发。
该疫苗是一种表达SARS-CoV-2刺突糖蛋白(S蛋白)的复制缺陷Ad5载体疫苗。疫苗使用一种减毒的普通感冒病毒(腺病毒,易感染人类细胞,但不致病)将编码SARS-CoV-2刺突(S)蛋白的遗传物质传递给细胞。随后这些细胞会产生S蛋白,并到达淋巴结,免疫系统产生抗体,识别S蛋白并击退冠状病毒。
5月22日,国际学术期刊《柳叶刀》在线发表全球首个重组腺病毒5型载体新冠疫苗I期临床试验结果。其主编理查德·霍顿评价道:“首次对此新冠病毒疫苗的人体实验结果发现,它具有良好的安全性和耐受性,并且能够诱导快速的免疫反应。这些结果代表着一个重要的里程碑。”
对于实验结果,陈薇院士指出:“这些结果使其成为具有潜力的可以进行下一步研究的候选疫苗。”
不过,她同时强调,“我们对这些结果应谨慎解读。研发COVID-19疫苗的挑战是前所未有的,诱导免疫应答的能力并不一定表明该疫苗能完全保护人类免受SARS-CoV-2的感染。这些结果为新冠疫苗研发提供了积极前景,但距离该疫苗上市,我们还有很多工作要做。”
陈薇院士查看核酸检测数据 图片来源:中国军网
事实上,疫情发生之初,我国科研攻关团队就把疫苗研发作为主攻方向之一,按照灭活疫苗、基因工程重组亚单位疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗和核酸疫苗等5条技术路线,共布局12项研发任务。目前已对1个腺病毒载体疫苗和4个灭活疫苗开展临床试验,占全世界开展临床试验疫苗总数的4成。
6月19日,联防联控机制疫苗研发专班专家组副组长王军志介绍,目前我们国家新冠疫苗的研究,已经有五家进入了临床试验阶段,其中,有三家已经完成了II期临床,所有研究的过程、研发的过程、评价的标准、保证安全有效的技术指南,都是符合国际标准的。
“下一步就必须积极开展临床III期试验,获得真正疫苗大人群的有效性保护率数据,这个对我们的疫苗最终取得成功极为重要。”他表示。
6月23日晚间,国药集团中国生物宣布,全球首个新冠灭活疫苗国际临床(三期)试验在阿联酋启动。这也是中国新冠疫苗在海外开展的第一个临床试验。
疫苗Ⅲ期临床试验为何要去国外做?
武汉生物制品研究所所长段凯介绍,临床研究通常分为三期。Ⅰ期主要评价安全性。Ⅱ期主要评价疫苗安全性和免疫原性,同时探索免疫程序。Ⅲ期主要在更大人群范围内评价疫苗的安全性和有效性。
“鉴于国内疫情得到有效控制,不具备Ⅲ期临床试验条件,新冠疫苗如果要做临床研究,要到国外疫情比较高发的地方去做。安全性评价贯穿整个临床研究全过程。如果Ⅲ期临床试验成功,说明这些疫苗是安全的、有效的,能保护接种人群免于新冠病毒感染。”他表示。











 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


