世界首个新冠肺炎治疗药物获批,为何WHO说它没用?(组图)
美国时间10月22日,广谱抗病毒药物瑞德西韦正式获得美国食品和药物管理局(FDA)批准,成为美国唯一完全获批的新冠治疗药物。
根据FDA声明,瑞德西韦适用于12岁以上且体重40公斤以上的新冠住院患者。且仅在下列医院或护理机构使用:能提供与住院医疗护理相当的急诊护理。针对非适应症患者,可遵循FDA此前发布的“紧急授权”使用该药。
瑞德西韦研发方吉利德科学公司同日声明称,公司有望在10月底满足全球用药需求。
这并非是瑞德西韦首次获批“新冠适应症”。6月中旬,印度上市两款瑞德西韦仿制药,用于治疗疑似或确诊新冠肺炎且病情严重的住院患者。
今年35岁的贾斯汀·福斯特告诉福克斯新闻台,10月初,他被确诊为新冠肺炎,于印第安那大学医院治疗。医生遵循“紧急授权”,给予其瑞德西韦。“用药前后的感受差别非常大。用药5天,我就出院了,不再喘息。”印第安那大学医院数据显示,5月初,该院已给500名患者使用瑞德西韦。用药后,患者症状明显改善,住院时间缩短。
但世界卫生组织(WHO)对此药的疗效,持不同看法。就在一周前,WHO在预印版平台,发布新冠病毒疗法随机对照研究“团结试验”(Solidarity Trial)中期报告,称瑞德西韦对预防新冠住院患者死亡或缩短住院时间,鲜有或没有疗效。该报告涉及30余国家、400多家医院、万余名患者,被称为世界上最大规模的新冠疗法随机对照试验。目前,其正在接受同行评议。
报告发布后,吉利德科学公司立即回应,称其没有严格的入组标准,却追求最大程度给予患者试验用药,设计缺乏严谨性。WHO则告诉媒体,前述研究旨在评估药物对降低住院新冠肺炎患者死亡率的效果,“结果极为充分”。

图片来源于TWITTER
《金融时报》报道,科学家们对FDA批准瑞德西韦上市,表示担忧。称美国总统大选在即,FDA或迫于政治压力,要彰显政府在此次抗疫中积极应对,而给瑞德西韦开绿灯。
北京大学人民医院药剂科夏雨告诉“医学界”,不应从政治因素考虑瑞德西韦是否有效。“我个人非常认可吉利德公司和WHO,就试验数据产生争论。WHO不是药品审批监管机构,在所发起的试验中只起协调作用,后续试验结果的解读和判断,以及药品上市后的安全评估仍应该由各国药品审批和监管机构判定。各国药品监管机构根据国家实际情况、用药习惯、经济承受能力等,选择性地解读研究证据。这是合理的。”
FDA和WHO的研究数据说明什么?
FDA声明表示,吉利德科学公司于8月递交瑞德西韦上市申请。最终获批,是基于3项随机对照临床试验。
美国有线电视新闻网(CNN)报道,美国国立卫生研究院(NIH)等机构联合进行的多中心随机双盲对照研究ACTT-1(NCT04280705),是FDA参考的核心数据。该研究涉及1062名住院患者,病情轻重不等、都有呼吸道症状,85%为重症。
结果显示,在瑞德西韦组(n=541),第一天给药200毫克,之后9天给药100毫克,患者中位康复时间为10天;在安慰剂组(n=521),中位康复时间为15天(p<0.001)。可见,与安慰剂组相比,瑞德西韦组能加速康复。但Kaplan–Meier法(生存分析)显示,在第15天和第29天,两组的死亡率不具备统计学显著差异。
FDA参考的第二项随机对照研究,于8月发表在《美国医学会杂志》(JAMA),补充了中症住院患者的疗效数据。在接受治疗11天后,5天瑞德西韦治疗组的临床表现显著改善。但10天瑞德西韦治疗组和标准治疗组的治疗效果没有明显差异。
第三项研究是于4月发布的SIMPLE研究Ⅲ期结果。它没有对照组,聚焦于重症住院患者。结果表明,5天疗程治疗组和10天疗程治疗组的临床结局没有显著差异。但用药时间对结局有影响。治疗后第14天,62%在发病10天内接受瑞德西韦治疗的患者出院。
49%在发病10天以上接受治疗的患者出院。CNN称,上述3个研究说明,瑞德西韦显示出适度益处。在感染初期就使用,或许能加速患者康复时间,但并不能显著提升存活率。

瑞德西韦正在进行灌装。/AP
《金融时报》称,WHO的“团结试验”否定了“加速康复”的效用。
“团结试验”显示,在瑞德西韦组(n=2743名),303人死亡,病死率为11%,相应对照组为11.2%(p=0.5)。结果不具备统计学差异。此外,瑞德西韦与对照组在试验期死亡率曲线高度重合,几乎无明显差距。在结论部分,“团结试验”援引ACTT-1,称没有数据支持瑞德西韦能减少机械通气(插管)率或缩短住院时间。
对于两个相左的结论,科学界说法不一。
《金融时报》援引英国利物浦大学药理学研究人员安德鲁·希尔发言称,FDA仅关注症状改善,并没有将死亡率等主要数据纳入评估。
关于“团结试验”,质疑则包括:涉及医院太多,各中心收治患者症状可能不一致。用药时间、剂量等存在差异,造成统计效果被稀释而不准确。
美国麻省总医院传染性疾病科主任罗切尔·沃伦斯基认为,瑞德西韦的初步数据显示对患者有一定益处,这足以支持其获批。但她补充道,若吉利德科学公司早前了解“团结试验”,却未将其纳入上市申请材料内,“这是不诚实的”。
“我觉得,要改变一个观念。FDA的标准不是最高的、唯一标准。各国监管机构对药品临床研究结果的解读不同,对药品上市的评定标准存在差异。但不能说其临床试验都存在争议。”夏雨告诉“医学界”。

瑞德西韦包装。/Getty Images
瑞德西韦:跌宕起伏的9个月
关于瑞德西韦的效用之争,从疫情暴发贯穿至今。
1月底,《新英格兰医学杂志》(NEJM)发表一名35岁新冠患者的康复全过程,称其入院第7天接受瑞德西韦治疗,显示出不错的临床效果。国人结合其拼写,称之为“人民的希望”。
4月29日,《柳叶刀》发表中日友好医院副院长曹彬等完成的随机、双盲、安慰剂对照临床试验。结果显示,瑞德西韦安全性、耐受性好,但与安慰剂相比,它的益处不明显。在治疗重症患者方面获益有限,亦未显著加快病毒载量下降速度。
就在同一天,吉利德科学公司发布声明,美国国家过敏症和传染病研究所(NIAID)开展瑞德西韦研究,取得积极数据。几天后,FDA针对瑞德西韦发布“紧急使用授权”。8月29日,“紧急授权”扩大到所有新冠住院患者。美国总统特朗普染疫后,亦使用该药。
针对中美结论不同,曹彬在4月接受澎湃新闻采访时表示:“这是两项不同的研究,评价标准不一样”,“一开始我们想象瑞德西韦是清华北大的苗子,但实际上他上不了,家长对他要求太高了。”
“医学界”发现,美国NIH一直在就瑞德西韦,进行更多探索。8月初,NIH发表声明,称已启动一项瑞德西韦和干扰素β-1a联合治疗Ⅲ期临床试验,将针对肺损伤患者、评估联合疗法能否缩短康复出院时间。
NIH当时称,初期结果将于今秋报告。截至本文发布,“医学界”未检索到相关信息。
6月,瑞德西韦定价公布,在美国每瓶售价520美元,在发达国家每瓶390美元。按照每人每疗程需使用至少6瓶来计算,一个疗程至少需2340美元,约合人民币1.65万元。
美国匹茨堡大学医学中心重症监护医学部主任德里克·安格斯指出,大规模生产和分配瑞德西韦的成本相当高昂。尤其是与已被证实有效,且广泛使用、价格低廉的皮质类固醇相比,瑞德西韦上市能否提供足够多的益处,现在还不清楚。
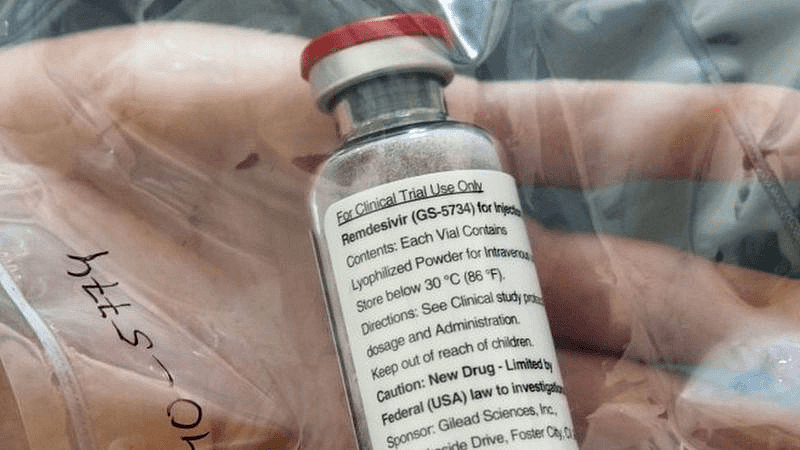
2020年4月,德国汉堡大学附属埃彭多夫医院召开新闻发布会,展示临床研究所用瑞德西韦。照片摄于2020年4月8日。/AFP











 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


